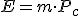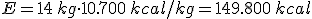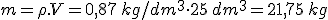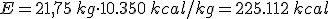3.3. Energía química
Una reacción química es un proceso en el que unas sustancias a las que llamamos reactivos se transforman en otras a la que llamamos productos. Así por ejemplo:
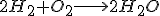
Es una ecuación química en la que se representa de forma ajustada como los reactivos, dos moléculas de hidrógeno reaccionan con una molécula de oxígeno, para producir los productos, en este caso dos moléculas de agua.
Si observáramos a nivel molecular esta reacción tendríamos algo similar a:

|
| Imagen 11: Reacción de combustión del hidrógeno. Recurso propio |
Es decir, para que se produzca la reacción es necesario:
- Romper tres enlaces químicos (uno por cada molécula de hidrógeno y otro en la molécula de oxígeno), esto supone un gasto de energía.
- Formar cuatro enlaces químicos (dos enlaces entre los átomos de hidrógeno y oxígeno de cada molécula de agua), estos procesos estabilizan al sistema liberando energía.
Energía química:
Energía que se libera o que hay que comunicar al sistema cuando se produce en él una reacción química.
En los procesos tecnológicos las reacciones químicas más habituales son las reacciones de combustión. En estas reacciones una sustancia llamada combustible reacciona con oxígeno para formar un producto y liberar energía en forma de calor. Esta energía se utilizará para realizar otros procesos.
La cantidad de energía que se puede obtener de un combustible depende de dos factores:
- Poder calorífico (Pc): Representa la energía que se puede obtener de un kg de combustible.
- Cantidad de combustible en masa o volumen según se trate de un combustible sólido o de un fluido.
Es decir:

 |
 |
| Imagen 12. Los alimentos son una fuente de energía química para los organismos vivos |
Imagen 13. El combustible al ser quemado libera la energía almacenada en sus enlaces químicos. |