1. Metales Pesados
 |
|
Imagen 1. isftic. Creative Commons
|
Se encuentra ampliamente disperso por todo el planeta, el mineral más abundante es la galena, sulfuro de plomo con una riqueza superior al 65% en plomo.
La extracción del plomo de la galena se realiza por calcinación de la mena, convirtiéndola en óxido y reduciendo el óxido con coque en altos hornos.
Otro método consiste en calcinar la mena en un horno de reverbero hasta que parte del sulfuro de plomo se transforma en óxido de plomo y sulfato de plomo. Se elimina el aporte de aire al horno y se eleva la temperatura, reaccionando el sulfuro de plomo original con el sulfato y el óxido de plomo, para formar plomo metálico y dióxido de azufre.
Propiedades
Aplicaciones

|
|
Imagen 2. Web sobre Museo Romano Cesaraugusta.©Roberto Lérida Lafarga
|
Prohibición de las tuberías de plomo
Cobre
Símbolo Cu. Número atómico es 29. Densidad 8,9kg/dm3. Punto de fusión 1083ºC. Resistencia a la tracción 18kg/mm2. Alargamiento 20%. Resistividad 0,017Ωm2/m.
Obtención. Estado natural.
 |
 |
| Imagen 3. isftic. Creative Commons | Imagen 4. isftic. Creative Commons |
El cobre puede encontrarse en estado puro. El cobre en bruto se tritura, y se separa por flotación y se concentra en barras. Los concentrados se funden en un horno de reverbero que produce cobre metálico con una pureza aproximada del 98%. Este cobre en bruto se enriquece por electrólisis, hasta alcanzar una pureza que supera el 99,9%. Los óxidos y carbonatos se reducen con carbono. Las menas más importantes, las formadas por sulfuros, no contienen más de un 12% de cobre.
El cobre puro es blando
El principal mineral de cobre es la calcopirita sulfuro de hierro y cobre, se encuentra en Chile, México, Estados Unidos y la antigua URSS; la azurita, carbonato de cobre, en Francia y Australia, y la malaquita, otro carbonato de cobre, la cuprita, un óxido de cobre que se encuentra en España.
Propiedades
Elevada conductividad del calor y electricidad, resistente a la corrosión, dúctil y maleable.
Aplicaciones
Era conocido en épocas prehistóricas, se han encontrado objetos de este metal en las ruinas de las civilizaciones antiguas.
 |
|
Imagen 5. isftic. Creative Commons
|
El cobre tiene una gran variedad de aplicaciones a causa de sus ventajosas propiedades, como son su elevada conductividad del calor y electricidad, la resistencia a la corrosión, así como su maleabilidad y ductilidad. Debido a su extraordinaria conductividad, sólo superada por la plata, el uso más extendido del cobre se da en la industria eléctrica. Por se ductilidad se puede transformar en cables de cualquier diámetro, desde 0,025 mm.
Las aleaciones de cobre, mucho más duras que el metal puro, pierden conductividad eléctrica, presentan una mayor resistencia a la tracción, gran resistencia a la corrosión y fácil mecanización.
A lo largo de la historia, el cobre se ha utilizado para acuñar monedas y confeccionar útiles de cocina, tinajas y objetos ornamentales.
Las aleaciones más importantes y profusamente utilizadas son:- Bronce, una aleación con estaño, se emplea en la fabricación de campanas, engranajes, esculturas.
- Latón, una aleación con zinc, se emplea en grifería, bisutería, envases...
A menor escala se emplean otras aleaciones como son:
- Cuproaluminio, se emplea para fabricar hélices de barco, tuberías.
- Alpaca, es una aleación con níquel y zinc de color plateado, se emplea en la fabricación de cuberterías y joyería barata.
- Cuproníquel, se emplea para la fabricación de monedas y de contactos eléctricos.
 |
 |
| Imagen 6. isftic. Creative Commons | Imagen 7. isftic. Creative Commons |
Cobalto
Símbolo Co. Su número atómico es 27. Densidad 8,9kg/dm3, Punto de fusión 1495ºC.
El cobalto fue descubierto en 1735.
Propiedades
De sus distintos isótopos conocidos, el cobalto 60 radiactivo es el más importante. Tiene una vida media de 5,7 años y produce una intensa radiación gamma. Por lo que se utiliza ampliamente en radioterapia.
Aplicaciones
Las superaleaciones resistentes a la temperatura contienen cobalto y son muy empleadas en la industria y en las turbinas de aviones.
Una aleación con acero, llamada acero de cobalto se utiliza para fabricar imanes permanentes. Con el carburo de wolframio, el cobalto y el cromo constituyen una aleación muy resistente usada para cortar y trabajar el acero. También se emplea en la industria de la cerámica y en el secado de pinturas, así como de catalizador.
 |
 |
|
| Imagen 8. Wikipedia. Creative Commons | Imagen 9. isftic. Creative Commons | |
Bomba de Cobalto
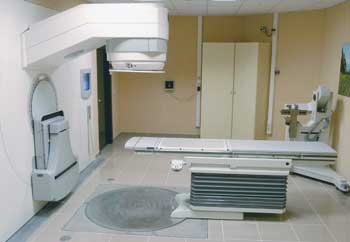 |
|
Imagen 10. todocancer. ©todocancer.com
|
Símbolo Sn. Número atómico 50. Densidad 7,28kg/dm3. Punto de fusión 231ºC. Resistencia a la tracción 5kg/mm2. Alargamiento 40%.Resistividad 0,115Ωm2/m.
Obtención. Estado naturalEl proceso de obtención parte de triturar la casiterita hasta convertirla en polvo y se baña en cubas que se agitan, para que por decantación el estaño ocupe la parte baja del depósito, se compacta tras eliminar la ganga. Después se somete a tostación, para reducir los óxidos de estaño, si se tiene que depurar su riqueza hasta alcanzar valores del orden de 99%, es necesario someterlo a procesos electrolíticos.
Propiedades
A temperatura ambiente es blando y maleable, es fácil obtener papel de escaso espesor.
Aplicaciones
 |

|
| Imagen 11. isftic. Creative Commons |
Imagen 12. isftic. Creative Commons |
Sabías que...
El estaño tiene la característica de cuando la temperatura desciende de -18ºC sufre un proceso degenerativo llamado la peste del estaño que provoca el que se descomponga en polvo.
Zinc
Símbolo Zn. Número atómico 30. Densidad 7,13kg/dm3. Punto de fusión 419ºC. Resistencia a la tracción según sean piezas moldeadas o forjadas 3-20kg/mm2. Alargamiento 20%. Resistividad 0,057Ωm2/m.
Propiedades
Es muy frágil a temperatura ambiente, pero se vuelve maleable entre los 120 y los 150 °C, por lo que se lamina fácilmente en rodillos calientes
Obtención. Estado natural
No se encuentra puro en la naturaleza y hasta el siglo XVII no se consiguió sintetizar. Los minerales más importantes son la blenda, sulfuro de zinc y sulfuro de plomo, con una riqueza del 50% de zinc y la calamina, silicato y carbonato de zinc, con riqueza inferior al 40%.
Aplicaciones
Aleado con el cobre para obtener latón.
El cloruro de zinc se usa para preservar la madera y como fluido soldador.
El sulfuro de zinc es útil en electroluminiscencia, fotoconductividad, semiconductividad y otros usos electrónicos; se utiliza en los tubos de las pantallas de televisión y en los recubrimientos fluorescentes.
 |
 |
 |
|
Imagen 13. isftic.Creative Commons |
Imagen 14. isftic. Creative Commons | Imagen 15. isftic. Creative Commons |
Cromo
Símbolo Cr. Número atómico 24. Densidad 7,2 kg/dm3. Punto de fusión es de 1.857 °C.
Propiedades
El cromo consigue aumentar la dureza y la resistencia a la corrosión de la aleación.
Aplicaciones
Se utiliza sobre todo en aleaciones de hierro, níquel o cobalto.
 |
| Imagen 16. isftic. Creative Commons |